studio concluso
Giovanna Del Pozzo: Istituto di Genetica e Biofisica-CNR, Napoli
Progetto Annuale
Studio sulla Celiachia
Area: Immunologia
- Numero del Finanziamento (Grant): FC 014/2014
- Titolo: Studio dell’espressione genica degli alleli HLA-DQ associati alla malattia celiaca nell’induzione di una risposta immunitaria anti-glutine da parte dei linfociti T CD4
- Area Scientifica: Genetica e Immunologia della malattia celiaca
- Durata: Progetto Annuale
- Ricercatore Titolare: Dott.ssa Giovanna Del Pozzo, Primo Ricercatore CNR, Istituto di Genetica e Biofisica del CNR di Napoli (IGB-CNR)
- Collaborazioni: Dott.ssa Carmen Gianfrani, Istituto di Biochimica delle Proteine del CNR (IBP-CNR)
Pubblicazioni su riviste scientifiche internazionali:
- Pisapia L, Camarca A, Picascia S, et al. HLA-DQ2.5 genes associated with celiac disease risk are preferentially expressed with respect to non-predisposing HLA genes: Implication for anti-gluten T cell response. J Autoimmun. 2016;70:63‐72. doi:10.1016/j.jaut.2016.03.016 https://pubmed.ncbi.nlm.nih.gov/27083396/
- Gianfrani C, Pisapia L, Picascia S, Strazzullo M, Del Pozzo G. Expression level of risk genes of MHC class II is a susceptibility factor for autoimmunity: New insights. J Autoimmun. 2018;89:1‐10. doi:10.1016/j.jaut.2017.12.016 https://pubmed.ncbi.nlm.nih.gov/29331322/
- Farina F, Picascia S, Pisapia L, et al. HLA-DQA1 and HLA-DQB1 Alleles, Conferring Susceptibility to Celiac Disease and Type 1 Diabetes, are More Expressed Than Non-Predisposing Alleles and are Coordinately Regulated. Cells. 2019;8(7):751. Published 2019 Jul 19. doi:10.3390/cells8070751 https://pubmed.ncbi.nlm.nih.gov/31331105/
- Pisapia L, Cerillo I, Farina F, et al. The HLA-DRB1 risk alleles for multiple sclerosis are differentially expressed in blood cells of patients from Southern Italy. Int J Immunogenet. 2019;46(6):479‐484. doi:10.1111/iji.12450 https://pubmed.ncbi.nlm.nih.gov/31313885/
- Pisapia L, Picascia S, Farina F, Barba P, Gianfrani C, Del Pozzo G. Differential expression of predisposing HLA-DQ2.5 alleles in DR5/DR7 celiac disease patients affects the pathological immune response to gluten. Sci Rep. 2020 Oct 14;10(1):17227. doi: 10.1038/s41598-020-73907-2. PMID: 33057065; PMCID: PMC7560598 https://pubmed.ncbi.nlm.nih.gov/33057065/
Lo studio
Cosa si è voluto studiare e perché?
La maggior parte dei pazienti celiaci presenta nel proprio corredo cromosomico i geni DQA1*05 e DQB1*02, definiti “predisponenti o di rischio”. I geni di rischio possono essere in duplice copia (omozigosi, ossia presenti su entrambi i cromosomi) o in singola copia (eterozigosi, ossia presenti su uno solo dei due cromosomi). È noto che la presenza di questi geni predisponenti in un individuo sano che ha parenti di primo grado affetti da celiachia costituisce un fattore di rischio, ossia di predisposizione allo sviluppo della malattia.
I geni DQA1*05 e DQB1*02 portano, attraverso un passaggio intermedio che comporta la formazione di molecole dette RNA messaggeri, alla produzione della molecola HLA-DQ2.5 che è espressa sulla superficie di alcune cellule dette “presentanti”. L’HLA-DQ2.5 ha un ruolo fondamentale nella celiachia perché è una molecola che lega alcune parti del glutine e stimola la reazione immunitaria ad opera dei linfociti T CD4. Questi linfociti, una volta attivati, cominciano a proliferare e infiltrano la mucosa dell’intestino tenue determinando il danno dell’organo (atrofia dei villi).
Figura 1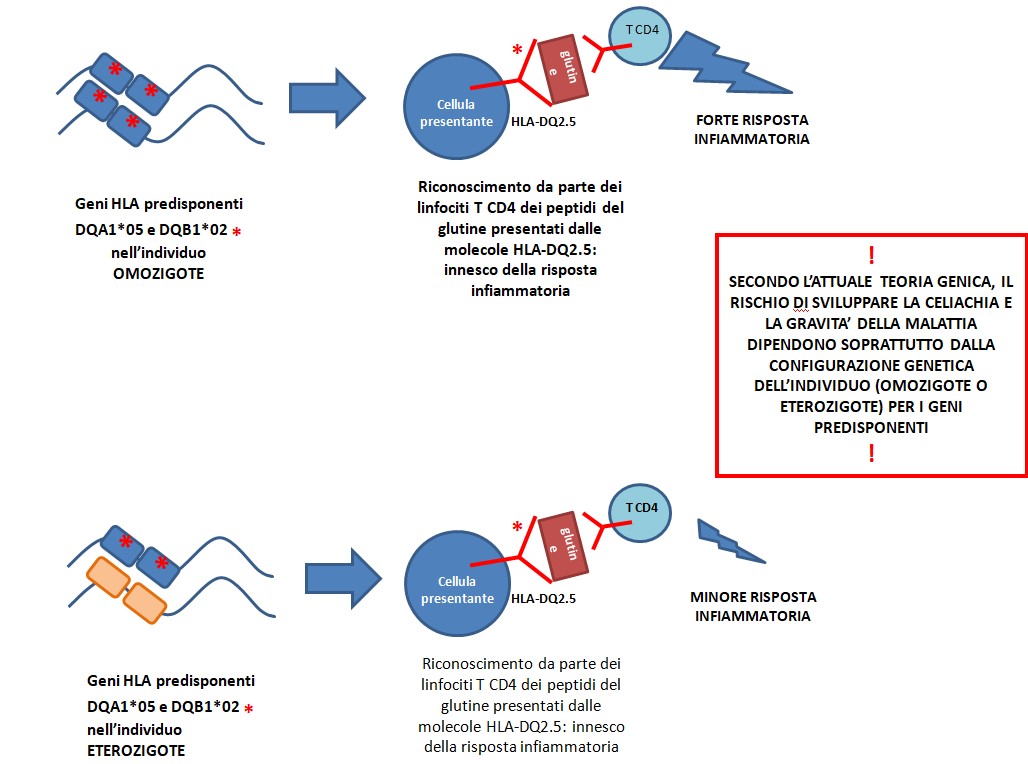
Figura 1 – Secondo l’attuale teoria genica, il rischio di sviluppare la celiachia e la gravità della malattia dipendono soprattutto dalla configurazione genetica dell’individuo (omozigote o eterozigote) per i geni predisponenti:
questo non spiega alcune incongruenze trovate nella classificazione dei pazienti nelle diverse classi di rischio. Partendo da questo scenario, lo studio ha inteso verificare la teoria del rischio genetico in funzione della configurazione dei geni di rischio, mediante misurazioni non solo della proteina HLA-DQ2.5, ma anche valutando quantitativamente il processo di formazione degli RNA messaggeri che portano alla proteina, in quanto si tratta di un passaggio chiave nella regolazione del fenomeno immunitario.
Secondo le attuali teorie (Figura 1), la configurazione genetica dei geni di rischio (omozigosi oppure eterozigosi) influenzerebbe l’efficacia con cui viene stimolato il sistema immunitario (quindi la risposta infiammatoria), e quindi l’individuo omozigote e quello eterozigote dovrebbero presentare un diverso rischio di sviluppare la malattia, dando luogo così a classi diverse di soggetti a rischio.
Partendo da questo scenario, lo studio ha inteso verificare la teoria del rischio genetico in funzione della configurazione dei geni di rischio, mediante misurazioni non solo della proteina HLA-DQ2.5, ma anche valutando quantitativamente il processo di formazione degli RNA messaggeri che portano alla proteina, in quanto si tratta di un passaggio chiave nella regolazione del fenomeno immunitario.
La Metodologia
Nello studio, cellule T CD4 glutine-specifiche sono state stimolate con cellule prelevate da pazienti celiaci sia omozigoti che eterozigoti per i geni di rischio (cellule presentanti), misurando poi la risposta immunitaria delle cellule T CD4 in funzione sia della quantità di proteina HLA-DQ2.5 sia dell’RNA messaggero espressi dalle cellule presentanti.
Quali Risultati?
I risultati hanno dimostrato che la configurazione genetica dei geni di rischio HLA DQA1*05 e DQB1*02 (omozigote o eterozigote) nelle cellule presentanti dei pazienti celiaci da sola non basta a spiegare l’attivazione infiammatoria delle cellule T CD4. La quantità di proteina HLA-DQ2.5 che lega il glutine e attiva la risposta immunitaria sembra invece dipendere soprattutto dai processi di formazione e regolazione dell’RNA messaggero negli omozigoti e negli eterozigoti: quando i geni predisponenti sono su un solo cromosoma (eterozigosi), essi tendono a produrre molto più RNA rispetto ai corrispettivi geni sull’altro cromosoma e quindi compensano l’effetto rispetto a quando sono presenti su entrambi i cromosomi (omozigosi). Si veda Figura 2.
Figura 2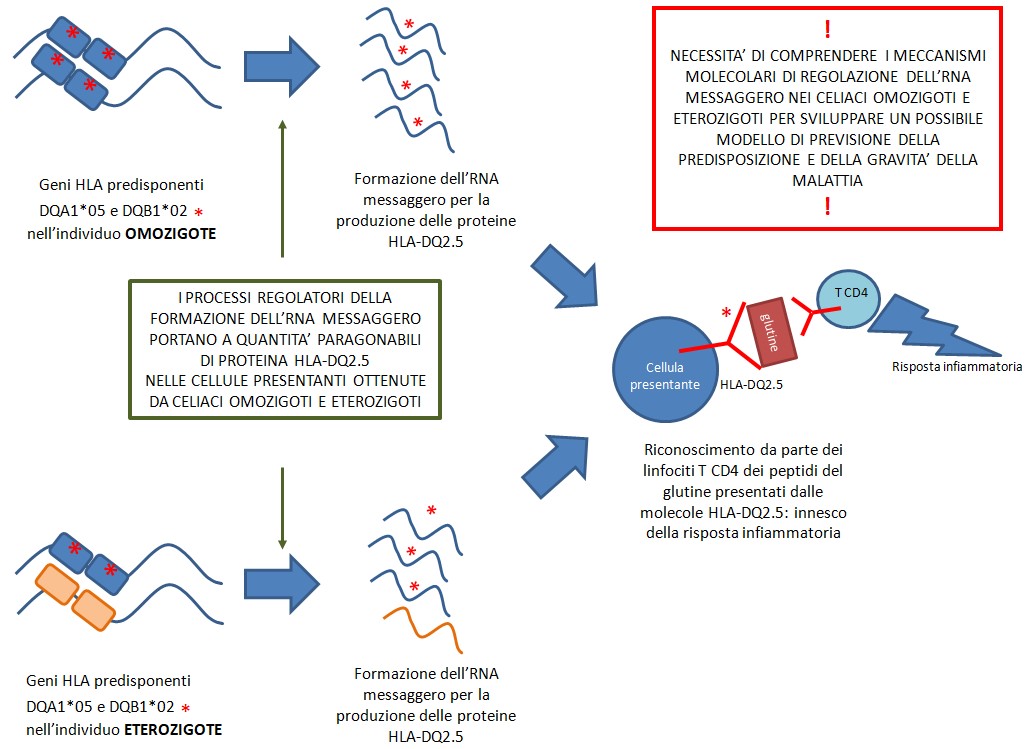 Figura 2 – Lo studio ha dimostrato che la quantità di proteina HLA-DQ2.5 che lega il glutine e attiva la risposta immunitaria non dipende solo dal fatto che un individuo sia omozigote o eterozigote per i geni HLA predisponenti, ma sembra dipendere soprattutto dai processi di formazione e regolazione dell’RNA messaggero negli omozigoti e negli eterozigoti: quando i geni predisponenti sono su un solo cromosoma (eterozigosi), essi tendono a produrre molto più RNA rispetto ai corrispettivi geni sull’altro cromosoma e quindi compensano l’effetto rispetto a quando sono presenti su entrambi i cromosomi (omozigosi). Questo potrebbe spiegare perché l’attuale teoria del dosaggio genetico (omozigote verso eterozigote) da sola non chiarisce alcune incongruenze trovate quando si vuole classificare il grado di rischio nei pazienti celiaci.
Figura 2 – Lo studio ha dimostrato che la quantità di proteina HLA-DQ2.5 che lega il glutine e attiva la risposta immunitaria non dipende solo dal fatto che un individuo sia omozigote o eterozigote per i geni HLA predisponenti, ma sembra dipendere soprattutto dai processi di formazione e regolazione dell’RNA messaggero negli omozigoti e negli eterozigoti: quando i geni predisponenti sono su un solo cromosoma (eterozigosi), essi tendono a produrre molto più RNA rispetto ai corrispettivi geni sull’altro cromosoma e quindi compensano l’effetto rispetto a quando sono presenti su entrambi i cromosomi (omozigosi). Questo potrebbe spiegare perché l’attuale teoria del dosaggio genetico (omozigote verso eterozigote) da sola non chiarisce alcune incongruenze trovate quando si vuole classificare il grado di rischio nei pazienti celiaci.
Si tratta di un risultato che potrebbe spiegare a livello molecolare perché l’attuale teoria del dosaggio genetico (omozigote verso eterozigote) da sola non chiarisce alcune incongruenze trovate quando si vuole classificare il grado di rischio nei pazienti celiaci. Lo studio aggiunge un ulteriore livello di valutazione della predisposizione alla celiachia in un soggetto a rischio: non solo la configurazione genetica dei geni di rischio ma anche i processi regolatori di formazione della proteina HLA-DQ2.5 (gli RNA messaggeri).
Quali prospettive e quali benefici per i pazienti celiaci?
In futuro, partendo da queste nuove acquisizioni molecolari sul processo di attivazione della risposta infiammatoria nel paziente celiaco, si potrà arrivare a progettare un dispositivo diagnostico che consenta di determinare non solo il genotipo ma anche la quantità di RNA dei geni predisponenti, e quindi prevedere il rischio di sviluppare la celiachia nei soggetti a rischio, e la gravità della malattia in ogni singolo paziente.
Ulteriori studi saranno necessari per capire qual è il meccanismo molecolare che genera una elevata produzione di molecole di RNA da parte dei geni HLA DQA1*05 e DQB1*02 nei soggetti eterozigoti.
Lo studio: approfondimenti
Lo scenario e gli obiettivi prefissati:
Circa il 95% degli individui affetti da celiachia possiede i geni HLA-DQA1*05 e HLA-DQB1*02 che determinano la produzione della molecola HLA-DQ2.5. Queste molecole hanno un ruolo chiave nella risposta immunitaria, in quanto legano quelle porzioni del glutine che vengono definite antigeni, riconosciuti come estranei dal nostro organismo, e attivano le cellule del sistema immunitario come i linfociti T CD4. I geni HLA che conferiscono il rischio di celiachia possono essere presenti su entrambi i cromosomi numero 6 (si parla allora di individuo omozigote per i geni di rischio) oppure su uno solo dei due cromosomi numero 6 (individuo eterozigote per i geni di rischio), mentre l’altro cromosoma 6 porta una variante (allele) dello stesso gene che non è associato alla malattia celiaca. Ciò ha fatto supporre che la molecola HLA-DQ2.5 debba essere presente, sulla superficie della cellula in cui viene prodotta, in una quantità variabile a seconda che il soggetto sia omozigote o eterozigote, il che a sua volta influenza l’intensità della reazione infiammatoria intestinale. Infatti i dati di letteratura riportano una correlazione tra il numero dei geni di rischio e la classificazione clinica cioè il livello di rischio di ammalarsi di celiachia. In altre parole è stato descritto un effetto legato al “numero di geni di rischio”, per cui secondo l’attuale teoria i soggetti omozigoti per i geni DQA1*05 e DQB1*02 dovrebbero avere sempre un rischio più alto di ammalarsi rispetto agli individui eterozigoti, in quanto stimolerebbero una reazione infiammatoria più elevata nei confronti del glutine introdotto con la dieta (Figura 1). Tuttavia questo modello non riesce da solo a spiegare alcune incongruenze che si trovano nel raggruppamento dei pazienti nelle varie classi di rischio.
Partendo da questo scenario, lo studio si è posto i seguenti obiettivi:
- confrontare l’intensità della risposta infiammatoria dei linfociti T CD4 glutine-specifici indotta dalle cellule immunitarie (dette presentanti perché legano il glutine e lo presentano ai linfociti T) prelevate da pazienti celiaci omozigoti con quella indotta dalle cellule presentanti prelevate da pazienti celiaci eterozigoti per i geni HLA di rischio
- misurare in tutti i casi studiati l’effettiva espressione sulla superficie delle cellule presentanti delle molecole HLA-DQ2.5 e la quantità dei corrispondenti RNA messaggeri che costituiscono la fase intermedia di produzione delle molecole HLA-DQ2.5, la fase soggetta a processi di regolazione e quindi di fondamentale importanza nel determinare sia la quantità di molecole HLA-DQ2.5 sia l’intensità della risposta infiammatoria
Il metodo:
Lo studio è stato effettuato adoperando cellule immunitarie presentanti (che legano il glutine attraverso le molecole HLA e lo presentano ai linfociti T) ricavate da pazienti celiaci sia omozigoti che eterozigoti, e da soggetti sani come campione di controllo, per un totale di 20 soggetti. In particolare sono stati usati i linfociti B (B-LCL) e le cellule dendritiche. Si tratta di cellule predisposte a monitorare la presenza nell’organismo di agenti estranei (quali il glutine) e, nel caso, ad attivare la risposta immunitaria. Le cellule presentanti sono state impiegate in test sia funzionali che molecolari. I test funzionali consistono nell’utilizzare le B-LCL e le cellule dendritiche come cellule che presentano i peptidi della gliadina (un componente del glutine) per attivare i linfociti T CD4 glutine-specifici precedentemente selezionati da biopsie di pazienti celiaci. L’attivazione dei linfociti T CD4 glutine-specifici è stata misurata mediante la quantificazione della citochina infiammatoria IFNγ. Per quanto riguarda i test molecolari è stata utilizzata sia la citofluorimetria a flusso, per quantificare le molecole HLA-DQ2.5 che erano presenti sulla superficie delle cellule presentanti, sia la real-time-PCR (qRT-PCR), per quantificare gli RNA messaggeri prodotti dai geni di rischio HLA-DQA1*05 e HLA-DQB1*02. Gli RNA messaggeri sono molecole intermediarie che sono prodotte a partire dai geni e servono a loro volta a generare le proteine, in questo caso le molecole HLA-DQ2.5, per cui la loro produzione e il loro funzionamento è soggetto a stretta regolazione da parte delle cellule: gli RNA messaggeri sono una delle fasi chiave nella produzione delle molecole HLA-DQ2.5 e quindi nel processo di induzione della risposta infiammatoria correlata alla celiachia.
I risultati:
Le B-LCL e le cellule dendritiche dei pazienti eterozigoti ed omozigoti, cioè rispettivamente con una o due copie dei geni di rischio DQA1*05 e DQB1*02, sono quindi state utilizzate come “cellule presentanti” i peptidi antigenici del glutine al fine di stimolare la proliferazione di linfociti T CD4 selezionati dalle biopsie dei pazienti. Si è visto che i linfociti T CD4 hanno proliferato in maniera paragonabile, cioè hanno indotto una risposta infiammatoria simile nonostante che ci si aspettasse che la quantità di antigene del glutine presentata dalle molecole HLA fosse diversa a seconda che la cellula presentante fosse omozigote o eterozigote. Detto in altri termini, dai risultati quantitativi ci si aspettava che, in base alle attuali conoscenze, l’individuo omozigote avesse sulle sue cellule presentanti più molecole di HLA rispetto all’individuo eterozigote, e quindi portasse ad una presentazione del glutine (e ad un’attivazione delle cellule T CD4) più massiccia rispetto all’individuo eterozigote. Invece si è osservato che l’intensità della risposta infiammatoria è la stessa in entrambi i casi. Per spiegare perché il test funzionale era uguale, è stata misurata la quantità di molecola DQ2.5 sulla superficie delle cellule presentanti: tale quantità non cambia in maniera significativa a seconda del genotipo omozigote o eterozigote delle cellule. A sua volta, per spiegare perché il numero di molecole HLA DQ2.5 fosse uguale, è stata misurata la quantità degli RNA messaggeri prodotti dai geni DQA1*05 e DQB1*02. Si è visto che la risposta al quesito è proprio nella produzione di RNA negli omozigoti e negli eterozigoti (Figura 2): quando i geni predisponenti sono su un solo cromosoma (eterozigosi), essi tendono a produrre molto più RNA rispetto ai corrispettivi geni sull’altro cromosoma e quindi compensano l’effetto rispetto a quando sono presenti su entrambi i cromosomi (omozigosi).
In conclusione i risultati rappresentano un completamento della teoria comunemente accettata del “dosaggio dei geni HLA”, cioè per l’instaurarsi dello stato patologico non è importante solo la presenza di una o due copie di geni di rischio DQA1*05 e DQB1*02, ma anche la quantità di RNA e quindi di proteine HLA-DQ2.5 che essi producono. Questo risultato, che conferisce un ruolo fondamentale al processo di formazione e regolazione degli RNA messaggeri nel meccanismo di attivazione della risposta infiammatoria contro il glutine, potrebbe spiegare perché le classi cliniche di rischio dei soggetti identificate secondo il metodo del dosaggio dei geni HLA predisponenti non sono sempre congruenti con la configurazione genetica (omozigosi verso eterozigosi): la configurazione genetica potrebbe non essere l’unico fattore determinante il rischio, ma anche la regolazione degli RNA messaggeri potrebbe svolgere un ruolo fondamentale che varia da soggetto a soggetto.
Prospettive e conseguenze future:
I risultati dello studio indicano che in aggiunta alla determinazione del genotipo HLA (presenza dei geni di rischio e loro configurazione, omozigosi o eterozigosi) anche la valutazione dell’espressione dei geni HLA di classe II associati alla celiachia dovrebbe essere utilizzato come strumento quantitativo di previsione del rischio di ammalarsi. A completamento dei risultati finora ottenuti dallo studio, le misurazioni molecolari dovranno essere valutate anche rispetto ai dati clinici che definiscono le diverse classi di rischio. In particolare lo studio dovrà essere esteso a pazienti appartenenti a differenti classi di rischio con altri genotipi, per esempio con due copie del gene DQB1*02 ed una del gene DQA1*05 oppure con i due geni di rischio su cromosomi diversi. Sulla base dei risultati ottenuti si potrà lavorare alla progettazione di un dispositivo diagnostico che permetta grazie ad un prelievo di sangue di determinare non solo il genotipo HLA ma anche l’espressione RNA dei geni di rischio nel singolo soggetto, fornendo indicazioni sia per un soggetto a rischio sulla probabilità di ammalarsi, sia per un paziente celiaco sulla gravità della patologia e quindi l’intensità della risposta infiammatoria.
Eventuali sviluppi futuri del progetto:
L’attività scientifica alla base del progetto è tuttora in corso e focalizzata allo studio dell’espressione dei geni HLA di rischio in pazienti con un assetto genico diverso. Inoltre uno degli obiettivi principali sarà quello di identificare i meccanismi molecolari a livello genomico che regolano i geni di rischio e determinano una elevata produzione di molecole HLA-DQ2.5.
Legenda
HLA (Human Leukocytes Antigens) sono le molecole espresse sulla superficie delle cellule “presentanti l’antigene” (dette brevemente cellule presentanti), le quali legano i peptidi del glutine e li presentano ai linfociti T CD4
Omozigosi è la condizione in cui le due copie di un gene (alleli, nel nostro caso i geni HLA predisponenti) presenti su entrambi i cromosomi sono identiche e producono lo stesso prodotto (proteina)
Eterozigosi è la condizione in cui le due copie di un gene (alleli) presenti su entrambi i cromosomi sono differenti e producono un prodotto proteico diverso; quindi nel nostro caso, solo uno dei cromosomi produce l’HLA predisponente
B-LCL (B-Lymphoblastoid Cell Lines): linfociti B estratti da sangue periferico di pazienti celiaci, si tratta di cellule presentanti. Portano le molecole HLA sulla loro superficie
Cellule dendritiche: Cellule immunitarie estratte da sangue periferico di pazienti celiaci, si tratta di cellule presentanti. Portano le molecole HLA sulla loro superficie
Linfociti T CD4 glutine-specifici: cellule che riconoscono i peptide del glutine quando questi si legano alle molecole HLA delle cellule presentanti, e in seguito al riconoscimento si attivano, proliferano e innescano una risposta infiammatoria mediata da molecole dette citochine, come la molecola IFNγ
Espressione: rappresenta la quantità di molecole di RNA messaggero generate a partire da un gene e quindi la quantità di molecole di proteine prodotte a partire dall’RNA messaggero
real-time qRT-PCR (Quantitative Reverse transcription polymerase chain reaction): Metodo per la quantificazione degli RNA nella cellula
citofluorimetria: È una tecnica che attraverso l’utilizzo di un laser consente il conteggio, la separazione e il rilevamento delle cellule
